Питание и здоровье сердца у собак и кошек

Здоровье сердца зависит от общего состояния здоровья питомца. Поддержание идеального физического состояния является важнейшим фактором, определяющим самочувствие собак и кошек. Проведение оценки питания в рамках каждого ветеринарного обследования может помочь владельцам домашних животных достичь целей, связанных со здоровьем их питомцев.
В контексте обеспечения здоровья сердца питание играет крайне важную роль в поддержании сердечной функции.
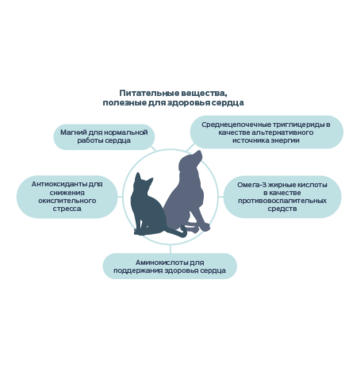
В данной статье приведены сведения о питательных веществах, благоприятно влияющих на здоровье сердца.
Жирные кислоты
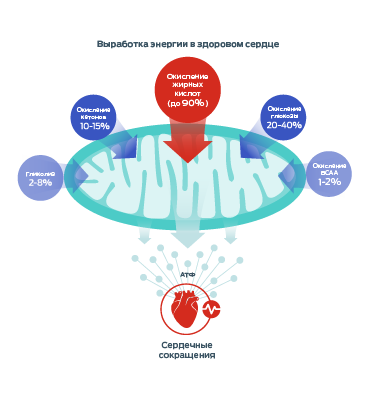
Эти питательные вещества являются основным субстратом, используемым митохондриями для выработки энергии для сердца в виде молекул аденозинтрифосфата (АТФ).
Однако митохондрии также обладают метаболической гибкостью: они могут использовать различные энергетические субстраты, адаптируясь к доступным питательным веществам, изменениям нагрузки на сердце и метаболического состояния. К другим источникам энергии относят глюкозу, кетоны и аминокислоты с разветвленной цепью (BCAA).1–3

Среднецепочечные триглицериды (MCT)
MCT являются источником среднецепочечных жирных кислот (MCFA). Обладая более короткими цепочками атомов углерода, жирные кислоты MCFA поступают в митохондрии без участия белков-переносчиков. Благодаря ускоренному процессу метаболизма MCFA быстрее окисляются, превращаясь в энергию.4
Исследования также показали, что MCT могут снижать концентрацию митохондриальных и цитоплазматических активных форм кислорода, что способствует замедлению прогрессирования заболевания сердца.5-8
Омега-3-полиненасыщенные жирные кислоты
Исследования показали, что длинноцепочечные омега-3-полиненасыщенные жирные кислоты, особенно эйкозапентаеновая кислота (EPA), обладают множеством преимуществ для сердца: они помогают снизить уровень медиаторов воспаления и окислительного стресса, сократить частоту аритмий у собак, снизить артериальное давление и уменьшить ремоделирование сердца при кардиологических заболеваниях.9-17
Сердечная кахексия часто встречается у собак с застойной сердечной недостаточностью, а характерную для этого заболевания потерю мышечной массы тела связывают со значительно более коротким временем выживания.18–19 Воспаление, вероятно, является причиной или предрасполагающим фактором развития кахексии. Таким образом, употребление омега-3 может также снизить неблагоприятное влияние воспаления на мышечную массу тела.20-22
Аминокислоты: таурин, лизин и метионин
Таурин — аминокислота, которая встречается в сердечной мышечной ткани наиболее часто. Несмотря на то, что его точная роль пока неизвестна, исследования показали, что таурин важен для поддержания сократительной функции сердечной мышцы и гомеостаза.23–25 У кошек таурин является незаменимой аминокислотой, однако дефицит таурина может привести к нарушению функции миокарда как у кошек, так и у собак.26
Лизин и метионин являются аминокислотами, которые используются для синтеза карнитина — пептида, помогающего транспортировать длинноцепочечные жирные кислоты в митохондрии для синтеза АТФ.27
Витамин Е
Активные формы кислорода (АФК) образуются в результате клеточного метаболизма. Однако накопление АФК в клетках приводит к повышению окислительного стресса, что вызывает повреждение клеточной мембраны и ДНК, а также денатурацию белков. Слишком высокая концентрация АФК также может спровоцировать череду молекулярных процессов, способствующих развитию сердечных заболеваний. Витамин E является антиоксидантом, который защищает клетки организма, захватывая АФК и предотвращая повреждения, вызываемые окислительным стрессом.
В условиях нарушения функции митохондрий, способствующего развитию сердечной недостаточности, уровень АФК повышается, из-за чего возрастает потребность в антиоксидантах.28–32

Магний
Магний выполняет множество функций для поддержания нормальной сердечной деятельности, обладая антиаритмическим и антиокислительным действием. В клетках сердца этот минерал также помогает осуществлять перенос АТФ. В организме человека существует взаимосвязь между низким уровнем магния и сердечной недостаточностью, а также повышенным риском сердечно-сосудистых заболеваний.33–36

Исследование компании Purina показало, что питание может благоприятно влиять на состояние сердца взрослого животного.
Сердце взрослого животного не может так же легко адаптироваться к новым условиям в случае заболевания или изменения окружающей среды, как сердце более молодого животного. Исследования показали, что повышение активности определенного молекулярного каскада, известного как Wnt/β-катениновый сигнальный путь, является одним из многих изменений, связанных с ускорением процессов старения.37–39
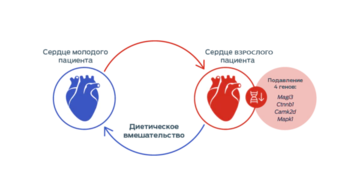
Научные сотрудники компании Purina отобрали общедоступные данные об экспрессии генов в клетках сердца взрослых животных.40, 41
Это исследование на основе вычислительного метода показало, что в клетках сердца более взрослых животных четыре гена сигнального пути Wnt были подавлены.
Однако изменение рациона, сопровождаемое ограничением калорий или приемом добавок, содержащих антиоксидант ресвератрол, позволило восстановить экспрессию генов до уровня, наблюдаемого в клетках сердца молодого животного.42–43
Это исследование продемонстрировало, что питание имеет положительное влияние на состояние сердца взрослого животного на молекулярном уровне, что способствовало проведению исследований роли определенных питательных веществ в поддержании или улучшении функции сердца.
- Многие питательные вещества признаны полезными для здоровья сердца.
- Жирные кислоты являются основным источником АТФ, вырабатываемого митохондриями в сердце.
- Вычислительное исследование компании Purina показало, каким образом питание может оказывать положительное влияние на состояние сердца взрослого животного.
- Doenst, T., Nguyen, T. D., & Abel, E. D. (2013). Cardiac metabolism in heart failure: implications beyond ATP production. Circulation Research, 113(6), 709–724.
- Lopaschuk, G.D., Ussher, J.R., Folmes, C.D., Jaswal, J.S., & Stanley, W.C. (2010). Myocardial fatty acid metabolism in health and disease. Physiological Reviews, 90(1), 207–258.
- Lopaschuk, G. (2017). Metabolic Modulators in Heart Disease: Past, Present, and Future. Canadian Journal of Cardiology, 33, 838–849.
- Labarthe, F., Gélinas, R., & Des Rosiers, C. (2008). Medium-chain fatty acids as metabolic therapy in cardiac disease. Cardiovascular Drugs and Therapy, 22(2), 97–106.
- Bach, A.C., & Babayan, V.K. (1982). Medium-chain triglycerides: an update. American Journal of Clinical Nutrition, 36(5), 950–962.
- Finck, B. N., Han, X., Courtois, M., Aimond, F., Nerbonne, J. M., Kovacs, A., Gross, R. W., & Kelly, D. P. (2003). A critical role for PPARalpha-mediated lipotoxicity in the pathogenesis of diabetic cardiomyopathy: modulation by dietary fat content. Proceedings of the National Academy of Sciences of the United States of America, 100(3), 1226–1231.
- Labarthe, F., Khairallah, M., Bouchard, B., Stanley, W.C., & Des Rosiers, C. (2005). Fatty acid oxidation and its impact on response of spontaneously hypertensive rat hearts to an adrenergic stress: benefits of a medium-chain fatty acid. American Journal of Physiology-Heart and Circulatory Physiology, 288(3), H1425–36.
- Saifudeen, I., Subhadra, L., Konnottil, R., & Nair, R. R. (2017). Metabolic Modulation by Medium-Chain Triglycerides Reduces Oxidative Stress and Ameliorates CD36-Mediated Cardiac Remodeling in Spontaneously Hypertensive Rat in the Initial and Established Stages of Hypertrophy. Journal of Cardiac Failure, 23(3), 240–251.
- Bauer, J.E. (2006). Metabolic basis for the essential nature of fatty acids and the unique dietary fatty acid requirements of cats. Journal of the American Veterinary Medical Association, 229(11), 1729–1732.
- Billman, G.E., Kang, J.X., & Leaf, A. (1999). Prevention of sudden cardiac death by dietary pure omega-3 polyunsaturated fatty acids in dogs. Circulation,99(18), 2452–2457.
- Freeman, L.M., Rush, J.E., Kehayias, J.J., Ross, J.N. Jr, Meydani, S.N., Brown, D.J., … Roubenoff, R. (1998). Nutritional alterations and the effect of fish oil supplementation in dogs with heart failure. Journal of Veterinary Internal Medicine, 12(6), 440–448.
- Freeman, L.M. (2010). Beneficial effects of omega-3 fatty acids in cardiovascular disease. Journal of Small Animal Practice, 51(9), 462–470.
- Laurent, G., Moe, G., Hu, X., Holub, B., Leong-Poi, H., Trogadis, J., Connelly, K., Courtman, D., Strauss, B. H., & Dorian, P. (2008). Long chain n-3 polyunsaturated fatty acids reduce atrial vulnerability in a novel canine pacing model. Cardiovascular Research, 77(1), 89–97.
- London, B., Albert, C., Anderson, M. E., Giles, W. R., Van Wagoner, D. R., Balk, E., … Lathrop, D. A. (2007). Omega-3 fatty acids and cardiac arrhythmias: prior studies and recommendations for future research: a report from the National Heart, Lung, and Blood Institute and Office Of Dietary Supplements Omega-3 Fatty Acids and their Role in Cardiac Arrhythmogenesis Workshop. Circulation, 116(10), e320–e335.
- Smith, C.E., Freeman, L.M., Rush, J.E., Cunningham, S.M., & Biourge, V. (2007). Omega-3 fatty acids in Boxer dogs with arrhythmogenic right ventricular cardiomyopathy. Journal of Veterinary Internal Medicine, 21(2), 265–273.
- Wall, R., Ross, R. P., Fitzgerald, G. F., & Stanton, C. (2010). Fatty acids from fish: the anti-inflammatory potential of long-chain omega-3 fatty acids. Nutrition Reviews, 68(5), 280–289.
- Hansen, R. A., Ogilvie, G. K., Davenport, D. J., Gross, K. L., Walton, J. A., Richardson, K. L., Mallinckrodt, C. H., Hand, M. S., & Fettman, M. J. (1998). Duration of effects of dietary fish oil supplementation on serum eicosapentaenoic acid and docosahexaenoic acid concentrations in dogs. American Journal of Veterinary Research, 59(7), 864–868.
- Ineson, D. L., Freeman, L. M., & Rush, J. E. (2019). Clinical and laboratory findings and survival time associated with cardiac cachexia in dogs with congestive heart failure. Journal of Veterinary Internal Medicine, 33(5), 1902–1908.
- Freeman, L.M. (2012). Cachexia and sarcopenia: emerging syndromes of importance in dogs and cats. Journal of Veterinary Internal Medicine, 26(1), 3–17.
- Dupont, J., Dedeyne, L., Dalle, S., Koppo, K., & Gielen, E. (2019). The role of omega-3 in the prevention and treatment of sarcopenia. Aging Clinical and Experimental Research, 31(6), 825–836.
- Gorjao, R., Dos Santos, C., Serdan, T., Diniz, V., Alba-Loureiro, T. C., Cury-Boaventura, M. F., Hatanaka, E., Levada-Pires, A. C., Sato, F. T., Pithon-Curi, T. C., Fernandes, L. C., Curi, R., & Hirabara, S. M. (2019). New insights on the regulation of cancer cachexia by N-3 polyunsaturated fatty acids. Pharmacology & Therapeutics, 196, 117–134.
- Robinson, S. M., Reginster, J. Y., Rizzoli, R., Shaw, S. C., Kanis, J. A., Bautmans, I., … Cooper, C., & ESCEO working group (2018). Does nutrition play a role in the prevention and management of sarcopenia? Clinical Nutrition (Edinburgh, Scotland), 37(4), 1121–1132.
- Sanderson S. L. (2006). Taurine and carnitine in canine cardiomyopathy. The Veterinary Clinics of North America. Small Animal Practice, 36(6), 1325–viii.
- Schaffer, S., Solodushko, V., & Azuma, J. (2000). Taurine-deficient cardiomyopathy: role of phospholipids, calcium and osmotic stress. Advances in Experimental Medicine and Biology, 483, 57–69.
- Schaffer, S. W., Jong, C. J., Ramila, K. C., & Azuma, J. (2010). Physiological roles of taurine in heart and muscle. Journal of biomedical science, 17, Suppl 1(Suppl 1), S2.
- Pion, P.D., Kittleson, M.D., Rogers, Q.R., & Morris, J.G. (1987). Myocardial Failure in Cats Associated with Low Plasma Taurine: A Reversible Cardiomyopathy. Science, 237, 764–768.
- Wang, Z., Liu, Y., Liu, G., Lu, H., Mao, C. (2018). L-Carnitine and heart disease. Life Sciences, 184, 88-97.
- Birringer, M., & Lorkowski, S. (2019). Vitamin E: regulatory role of metabolites. International Union of Biochemistry and Molecular Biology, Life, 71(4), 479–486.
- Michałek, M., Tabiś, A., Cepiel, A., & Noszczyk-Nowak, A. (2020). Antioxidative enzyme activity and total antioxidant capacity in serum of dogs with degenerative mitral valve disease. Canadian Journal of Veterinary Research, 84(1), 67–73.
- Pryor, W. A. (2000). Vitamin E and heart disease: basic science to clinical intervention trials. Free radical biology & medicine, 28(1), 141–164.
- Sagols, E., & Priymenko, N. (2011). Oxidative stress in dog with heart failure: the role of dietary fatty acids and antioxidants. Veterinary Medicine International, 2011, 180–206.
- Sozen, E., Demirel, T., & Ozer, N.K. (2019). Vitamin E: regulatory role in the cardiovascular system. International Union of Biochemistry and Molecular Biology Life, 71(4), 507–515.
- Del Gobbo, L.C., Imamura, F., Wu, J.H., de Oliveira Otto, M.C., Chiuve, S.E., & Mozaffarian, D. (2013). Circulating and dietary magnesium and risk of cardiovascular disease: a systematic review and meta-analysis of prospective studies. American Journal of Clinical Nutrition, 98(1), 160–173.
- Freeman, L.M., Rush, J.E., & Markwell, P.J. (2006). Effects of dietary modification in dogs with early chronic valvular disease. Journal of Veterinary Internal Medicine, 20, 1116–1126.
- Qu, X., Jin, F., Hao, Y., Li, H., Tang, T., Wang, H., Yan, W., & Dai, K. (2013). Magnesium and the risk of cardiovascular events: a meta-analysis of prospective cohort studies. PloS one, 8(3), e57720.
- Tardy, A.L., Pouteau, E., Marquez, D., Yilmaz, C., & Scholey, A. (2020). Vitamins and Minerals for Energy, Fatigue and Cognition: A Narrative Review of the Biochemical and Clinical Evidence. Nutrients, 12(1). pii: E228.
- Brack, A. S., Conboy, M. J., Roy, S., Lee, M., Kuo, C. J., Keller, C., & Rando, T. A. (2007). Increased Wnt signaling during aging alters muscle stem cell fate and increases fibrosis. Science (New York, N.Y.), 317(5839), 807–810.
- Liu, H., Fergusson, M. M., Castilho, R. M., Liu, J., Cao, L., Chen, J., … Finkel, T. (2007). Augmented Wnt signaling in a mammalian model of accelerated aging. Science (New York, N.Y.), 317(5839), 803–806.
- Marchand, A., Atassi, F., Gaaya, A., Leprince, P., Le Feuvre, C., Soubrier, F., Lompré, A. M., & Nadaud, S. (2011). The Wnt/beta-catenin pathway is activated during advanced arterial aging in humans. Aging Cell, 10(2), 220–232.
- Li, Q., & Hannah, S. S. (2012). Wnt/β-catenin signaling is downregulated but restored by nutrition interventions in the aged heart in mice. Archives of Gerontology and Geriatrics, 55(3), 749–754.
- Barger, J. L., Kayo, T., Vann, J. M., Arias, E. B., Wang, J., Hacker, T. A., Wang, Y., Raederstorff, D., … Prolla, T. A. (2008). A low dose of dietary resveratrol partially mimics caloric restriction and retards aging parameters in mice. PloS one, 3(6), e2264.